Программа Составления Химических Уравнений
Для тех, кто только начинает знакомство с химией или просто нуждается в помощи, данное приложение очень поможет. Введение: Одним из самых сложных предметов, особенно для меня, была именно химия, поскольку я ну никак не мог понять как правильно составлять уравнения. Антивирус avg на русском. Во время моего учения в школе не было смартфонов, а были лишь только обычные Java-телефоны, на которых подобный функционал, как сейчас – это была только мечта, и то только для пользователей Windows Mobile или Symbian. Сейчас же все поменялось и благодаря приложению « Реакции. Решатель по химии» вы с легкостью сможете уровнять химические реакции, а также получить уведомление об ошибке, если оно где-то допущено. Еще одним несомненным плюсом будет наличие оффлайн режима, который позволит использовать приложение где угодно и когда угодно.
- Программа Для Составления Химических Уравнений
- Программа Для Составления Химических Реакций Онлайн
- Программа Для Составления Химических Реакций
Главный экран состоит из двух полей ввода данных – реагенты и продукты. Сверху присутствует клавиатура, которая поможет вам проставлять индексы в ваших выражениях, а также знаки плюс, скобки круглые и квадратные. Если вы хотите просто проверить работу приложения, достаточно ввести пример, который указан под каждой из строк, а затем нажать кнопку «Уравнять». Если вы пропустите хотя бы один элемент, то получите комментарий под одной из строк. Если вы хотите получить справку о том, что же все-таки выполняет приложение, то нажмите на знак вопроса на верхней панели. В разделе справки, авторы постарались максимально полно рассказать о том, что и как происходит, что вычисляется и вообще означает конечная запись, которая вам в итоге выдается, а также указаны правила, которыми вы сможете пользоваться самостоятельно, чтобы уравнивать такие выражения. Но учтите, что приложение расписывает только коэффициенты, а само решение и степени окисления вам придется писать самостоятельно (ну хоть что-то нужно же делать самому, если хотите выучить химию).
Программа Для Составления Химических Уравнений
Учимся составлять химические уравнения. Видео для начинающих. Ссылка на видео. Составление химических уравнений. Химические уравнения помогают не только описывать.
Также стоит отметить, что запись “fe” и “Fe” – это две разные вещи, поэтому пишите все правильно, если хотите получить корректный ответ. На этом весь функционал приложения заканчивается, поскольку остальное считать нужно вручную. Подведем итоги: « Реакции.
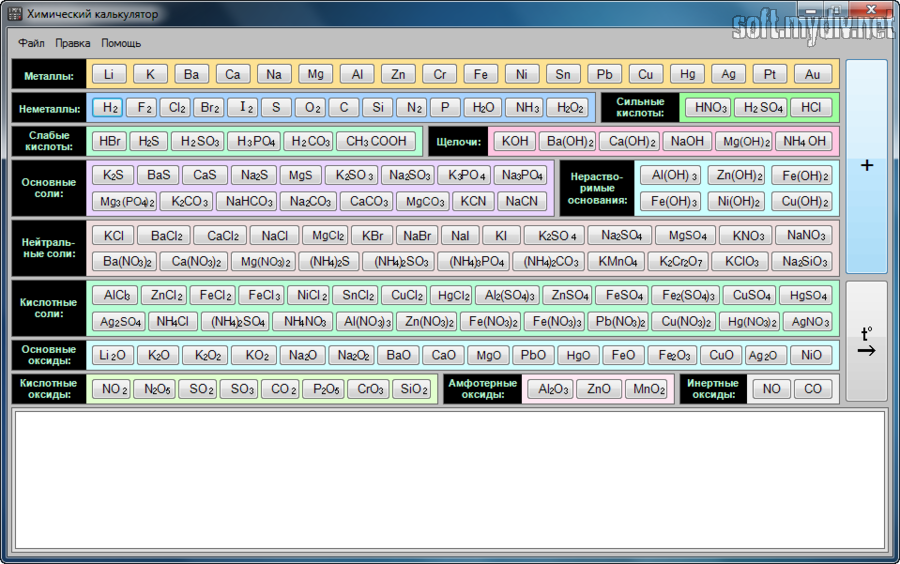
Решатель по химии» - это одно из приложений, которое 100% станет незаменимым инструментом для всех школьников, изучающих химию и хотящих получить минимальные знания в области химии, поскольку данная наука очень интересна, хотя и очень сложна для восприятия и понимания (лично мое мнение). Также большинство пользователей порадует отсутствие надобности в интернете, т.к.
Программа Для Составления Химических Реакций Онлайн
Не во всех странах и городах, есть возможность использования интернета. Приятного пользования!
Химические реакции. Составление уравнений химических реакций. Составление уравнений химических реакций Доц. Петрова Елена АлександровнаМосковский Государственный Строительный Университет. Основные вопросы Валентность. Составление формул химических веществ по валентностям Закон сохранения массы веществ Составление уравнений химических реакций и расстановка коэффициентов методом подбора. ВАЛЕНТНОСТЬ.
ХИМИЧЕСКИЕ ФОРМУЛЫ. СОСТАВЛЕНИЕ ФОРМУЛ ВЕЩЕСТВ ПО ВАЛЕНТНОСТЯМ.Валентность - это свойство атомов одного химического элементаприсоединять определённое число атомов другого.Для составления формул веществ нужно знать количественные соотношенияатомов элементов.Валентность показывает, со сколькими атомами одновалентногоэлемента соединяется атом данного элемента. Химические соединения одновалентные поливалентныеЭлементы, атомы которых в Элементы, атомы которых в всегдадвухэлементных соединениях всегда связаны с несколькими атомамисвязаны с одним атомом другого другого элемента.элемента. Например, кислород, железо, медьНапример, водород. Таблица постоянных валентностей. Валентности Элементы I H, Na, Li, K, Rb, Cs II O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd III B, Al, Ga, In Переменная валентность:.Cu — I и II.Fe, Co, Ni — II и III.C, Sn, Pb — II и IV.P — III и V.Cr — II, III и VI.S — II, IV и VI.Mn — II, III, IV, VI и VII.N — 2, 3, 4, 5.Cl — 1, 4, 6, 7. Используя валентности можно составить формулу соединения.Химическая формула-это условная запись состава вещества посредствомхимических знаков и индексов.Например: H2O-формула воды, где Н и О-химические знаки элементов, 2-индекс,который показывает число атомов данного элемента, входящих в состав молекулыводы.При названии веществ с переменной валентностью обязательно указывается еговалентность, которая ставится в скобки.
Например, Р2О5- оксид фосфора (V). Составление формул по валентностям.Правило: что число валентностей у одного химического элемента равночислу валентностей у другого.Пример образования молекулы, состоящей из фосфора и кислорода.1. Записываем рядом символы химических элементов:2.
Ставим над химическими элементами их валентности римскими цифрами,у фосфора равна 5, у кислорода-2.3. Находим наименьшее число, которое делится без остатка на 5 и на 2. Делим его на валентности элементов 10:5=2, 10:2=5, 2 и 5 будутиндексами, соответственно у фосфора и кислорода. Подставляем индексы. Максимальная степень окисления элемента определяется по номеру его группы.
Степень окисления Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Пример: Cl2O7 1. Выпишем степень Для определения степени окисления (n) атома следует окисленияисходить из следующего: кислорода. А) степень окисления атомов в простых веществах равна нулю; 2. Обозначим б) степень окисления одноатомного иона всегда равна его неизвестную с.о. Заряду: Na+, Ba2+; хлора через Х: в) степень окисления кислорода во всех соединениях, кроме Cl2+х O7-2, OF2 и перекисных соединений n = - 2; 3.
Составим уравнение: г) степень окисления водорода, связанного с неметаллами, nH = +1, а в солеобразных гидридах (соединениях с 2∙х+(-2)∙7=0 активными металлами) nH = -1; 2∙х -14=0 д) сумма степеней окисления всех атомов в молекуле равна 2∙х=+14 нулю. Х=+7 +7 Ответ: Cl2 O7-2. Химическая формула – условная запись состава вещества с помощью химических знаков и индексов.
Проекты. Окна - пластиковые. Основные технико-экономические показатели Общая площадь здания – 301,45 кв.
Программа Для Составления Химических Реакций

Индекс показывает число атомов в формульной единице вещества. Коэффициент показывает число несоединенных друг с другом частиц Химическая формула Коэффициент ИндексНа основании данного закона составляютуравнения химических реакций хА + уВ = сАВ. ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВМасса веществ, вступивших в химическую реакцию,равна массе веществ, получившихся в результате ее.
С точки зрения атомно-молекулярного учения закон сохранениямассы объясняется так:Т. Число атомов до реакции и после остается неизменным, то ихобщая масса также не изменяется. Алгоритм составления уравнений реакций и расстановки коэффициентов методом подбора: 1. В левой части уравнения пишут формулы веществ, вступивших в реакцию (исходные вещества), а затем ставят стрелку. В правой части (после стрелки) пишут формулы веществ, образующихся в результате реакции (продукты реакции). Mg + O2 MgO 3. Уравнение реакции составляют на основе закона сохранения массы веществ, т.е.
Слева и справа должно быть одинаковое число атомов, что достигается расстановкой коэффициентов перед формулами веществ. 2Mg + O2 2MgO4. Затем проверяют число атомов каждого элемента в левой и правой частях уравнения. Примеры реакций Железо + сера →сульфид железа (II ) Fe + S → FeS.
Примеры составления уравнений реакций:4Al +3O2 →2Al2 O3 Al 3+ O 2-Теперь уравниваем коэффициенты. 4 Fe +3O2 →2Fe 2 O 3 Fe 3+ O 2- Al2S3 + 6H2O → 2 Al(OH)3 +3 H2S HOH. Уравняйте химические реакции:2 KOH + H2SO4 → K2SO4 +2H2O HOH2 Fe(OH)3 +3 SO3 →Fe2(SO4)3 +3 H2O Cu(OH)2 +2 HNO3 →Cu(NO3)2 + 2H2O Na2SiO3 + 2HCl→H2SiO3 + 2NaCl.